Процедура "Уведомление о выявлении критических несоответствий" (P.MM.11.PRC.004)
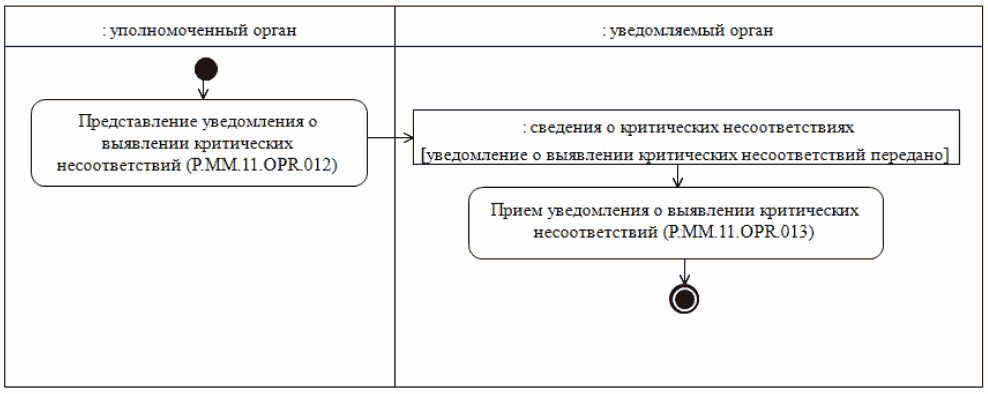
50. Схема выполнения процедуры "Уведомление о выявлении критических несоответствий" (P.MM.11.PRC.004) представлена на рисунке 8.
Рис. 8. Схема выполнения процедуры "Уведомление о выявлении
критических несоответствий" (P.MM.11.PRC.004)
51. Процедура "Уведомление о выявлении критических несоответствий" (P.MM.11.PRC.004) выполняется в случае выявления при проведении фармацевтической инспекции критических несоответствий с целью взаимного оперативного информирования уполномоченных органов о таких случаях.
52. Первой выполняется операция "Представление уведомления о выявлении критических несоответствий" (P.MM.11.OPR.011), по результатам выполнения которой уполномоченный орган направляет в уведомляемый орган уведомление, содержащее сведения о выявлении при проведении фармацевтической инспекции критических несоответствий.
53. При поступлении в уведомляемый орган уведомления, содержащего сведения о выявлении при проведении фармацевтических инспекций критических несоответствий, выполняется операция "Прием уведомления о выявлении критических несоответствий" (P.MM.11.OPR.013), по результатам выполнения которой уведомляемый орган получает указанные сведения.
54. Результатом выполнения процедуры "Уведомление о выявлении критических несоответствий" (P.MM.11.PRC.004) является получение уведомляемым органом сведений о выявлении критических несоответствий при проведении фармацевтических инспекций фармацевтическим инспекторатом другого государства-члена.
55. Перечень операций общего процесса, выполняемых в рамках процедуры "Уведомление о выявлении критических несоответствий" (P.MM.11.PRC.004), приведен в таблице 21.
Перечень операций общего процесса, выполняемых
в рамках процедуры "Уведомление о выявлении критических
несоответствий" (P.MM.11.PRC.004)
|
представление уведомления о выявлении критических несоответствий |
приведено в таблице 22 настоящих Правил |
|
|
приведено в таблице 23 настоящих Правил |
Описание операции "Представление уведомления о выявлении
критических несоответствий" (P.MM.11.OPR.012)
|
представление уведомления о выявлении критических несоответствий |
||
|
выполняется при необходимости взаимного оперативного информирования уполномоченных органов других государств-членов о выявлении при проведении фармацевтической инспекции критических несоответствий |
||
|
сведения о выявлении при проведении фармацевтической инспекции критических несоответствий представляются в течение 5 рабочих дней с даты завершения фармацевтической инспекции. Формат и структура представляемых сведений должны соответствовать Описанию форматов и структур электронных документов и сведений |
||
|
исполнитель направляет уведомление, содержащее сведения о выявленных при проведении фармацевтической инспекции критических несоответствий, в уведомляемый орган в соответствии с Регламентом информационного взаимодействия между уполномоченными органами |
||
|
уведомление, содержащее сведения о выявлении при проведении фармацевтической инспекции критических несоответствий, представлено в уведомляемый орган |
Описание операции "Прием уведомления о выявлении критических
несоответствий" (P.MM.11.OPR.013)
|
выполняется при получении исполнителем уведомления, содержащего сведения о выявлении при проведении фармацевтической инспекции критических несоответствий (операция "Представление уведомления о выявлении критических несоответствий" (P.MM.11.OPR.012)) |
||
|
формат и структура сведений должны соответствовать Описанию форматов и структур электронных документов и сведений. Реквизиты электронного документа (сведений) должны соответствовать требованиям, предусмотренным разделом IX Регламента информационного взаимодействия между уполномоченными органами |
||
|
исполнитель принимает уведомление, содержащие сведения о выявлении при проведении фармацевтической инспекции критических несоответствий, в соответствии с Регламентом информационного взаимодействия между уполномоченными органами |
||
|
уведомление, содержащее сведения о выявлении при проведении фармацевтической инспекции критических несоответствий, получено уведомляемым органом |
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2025
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875