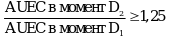71. Необходима поправка первичных показаний хромаметра для каждого профиля "побледнение кожи - время" (для участков с нанесенным лекарственным препаратом и контрольных участков без нанесения) на исходное значение на данном участке. Следует скорректировать каждый участок нанесения лекарственного препарата после поправки относительно исходного уровня по среднему значению из 2 контрольных участков на той же руке с поправкой относительно исходного уровня (таблицы 1 - 4 приложения N 4 к настоящим Требованиям).
Следует рассчитать AUEC для каждой скорректированной относительно исходного уровня длительности воздействия дозы на контрольных участках (таблицы 3 - 6 приложения N 4):
AUEC0-24 для нанесения препарата в разное время с последующим синхронным удалением;
AUEC(D2-28) (от времени D2 до 28 часов) для синхронного нанесения препарата с последующим удалением в разное время.
В анализ данных допускается включать только данные "детекторов", то есть субъектов, значения AUEC которых для двух длительностей воздействия D1 и D2 являются отрицательными и которые отвечают критерию "длительность воздействия дозы - ответ", описанному в таблице 6 приложения N 4 и в таблице 1 приложения N 5.
Критерий "длительность воздействия дозы - ответ":
AUEC в момент D2 = 0,5 x (AUEC в момент D2 (левая рука) + AUEC в момент D2 (правая рука));
AUEC в момент D1 = 0,5 x (AUEC в момент D1 (левая рука) + AUEC в момент D1 (правая рука)).
72. Анализ данных проводится в отношении субъектов с полным набором данных, то есть с данными о результатах двукратных оценок D1 и D2 и четырехкратных оценок исследуемого и референтного лекарственных препаратов и контрольных участков.
73. Оценка биоэквивалентности должна быть основана на значениях AUEC, рассчитанных в соответствии с пунктом 71 настоящих Требований при длительности воздействия дозы, приблизительно равной ED50 для исследуемого и референтного лекарственных препаратов (на участках, которые указаны в пункте 68 настоящих Требований).
74. Необходимо представить все данные исследования, включая данные субъектов, не ответивших на лечение. Любые данные, не используемые в оценке биоэквивалентности, необходимо сопроводить обоснованием (например: "субъект, не ответивший на лечение", "перекрывание сосудосуживающих эффектов на соседних участках" и др.).
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2026 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875